Die COI-PharmaSuite ist eine konfigurierbare Standardsoftwarelösung (COTS) für die Life Science Branche. Sie umfasst verschiedene Module für die Dokumentation von Qualitäts- und Zulassungsprozessen (SOP-Management, eCTD u. v. m.) und bietet einen umfassenden Dokumentenlifecycle.
Durch die kontinuierliche Weiterentwicklung der Lösung und die fortwährende Integration verschiedener internationaler Regularien in die Prozessgestaltung, erhalten Sie FDA- und EMA-konforme Lösungen für Ihre technische Dokumentation, elektronische Arzneimittelzulassung und das SOP-Management.
Die COI-PharmaSuite beinhaltet folgende –
frei kombinierbare – Teilmodule:
Qualitätsmanagement
Unternehmen der Life Science Industrie und verwandter Branchen wie der Kosmetik, Nahrungsergänzungsmittel oder Lebensmittelbranche sehen sich heute im Bereich der Qualitätssicherung mit immer höheren behördlichen Anforderungen konfrontiert.
Unabdingbar für eine transparente Produktentwicklung ist ein effizienter QM-Prozess.
Mit der COI-PharmaSuite bilden wir alle wichtigen Bereiche für das Qualitätsmanagement in stark regulierten Märkten ab. Drei Hauptmodule sind derzeit einzeln erhältlich und frei kombinierbar.
Die QM Module im Überblick

Effizientes SOP-Management
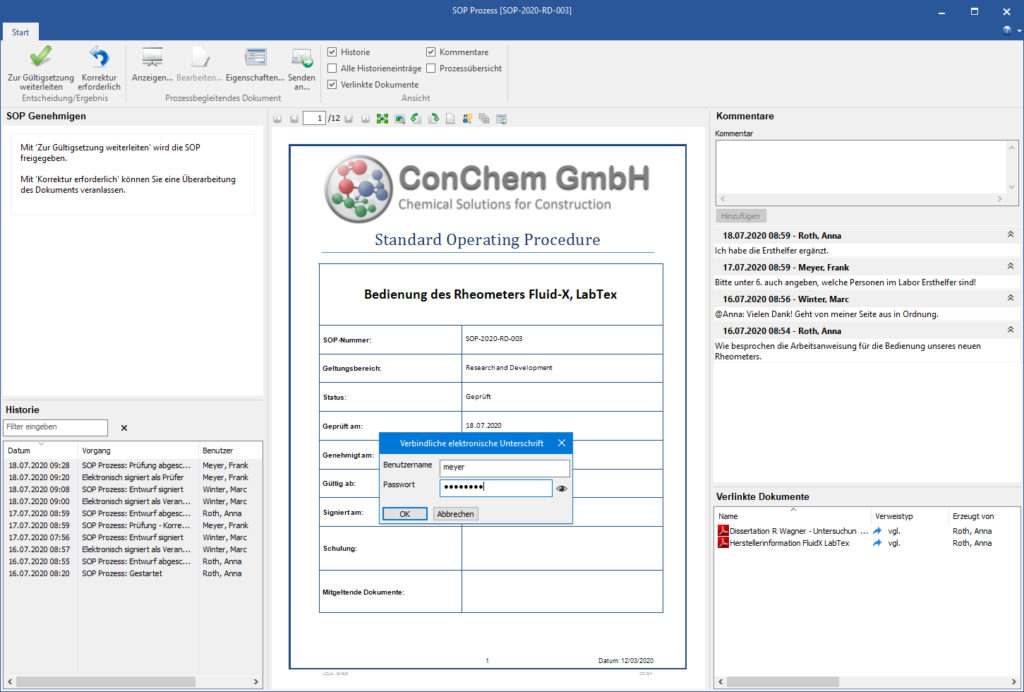
Mit dem SOP–Management (Standard Operating Procedures) der COI-PharmaSuite werden die Anwender sowohl bei der Erstellung der SOP-Dokumente, als auch bei der elektronischen Freigabe und Verteilung derselben ganzheitlich unterstützt. Ein konfigurierbarer Standardworkflow für Dokumentenlenkung und Lifecycle bringt klare Strukturen und sorgt für nahtlose Schnittstellen zu anderen QM Modulen.
Dabei orientieren sich unsere Workflows stets an den aktuellsten Vorgaben, sind selbstverständlich GxP-konform sowie gemäß ISO 13485 Richtlinien konfiguriert. Unsere Software ist darüber hinaus nach Grundsätzen des GAMP (Good Automated Manufacturing Practice) entwickelt und damit entsprechend für die Übernahme der Datenverwaltung im Rahmen des SOP-Managements zertifizierbar. Die notwendigen Funktionen Audit Trail, Rollen/Berechtigungen, Versionierung und Archivierung sind selbstverständlich perfekt im Lifecycle der SOP verankert.
Erstellen / Bearbeiten
Mit der SOP Lösung der COI-PharmaSuite wird der Prozess der Dokumenterstellung auf Basis von Vorlagen unterstützt.
Prüfung
Nachdem das Autorenteam eine SOP erstellt hat, sieht der Workflow eine formale Prüfung durch weitere Funktionsträger vor. Die digitale Freigabe erfolgt mit wenigen Klicks auf Basis einer elektronischen Signatur und kommt ganz ohne Medienbrüche aus. Die Entscheidung über die Freigabe und die Signaturen werden selbstverständlich im Audit–Trail dokumentiert.
Signatur und Freigabe
Nach der Prüfung durchläuft jede SOP innerhalb des Workflows einen formale Freigabe-Schritt. Dieser kann Funktionsträger aus einer oder mehreren Abteilungen beinhalten.
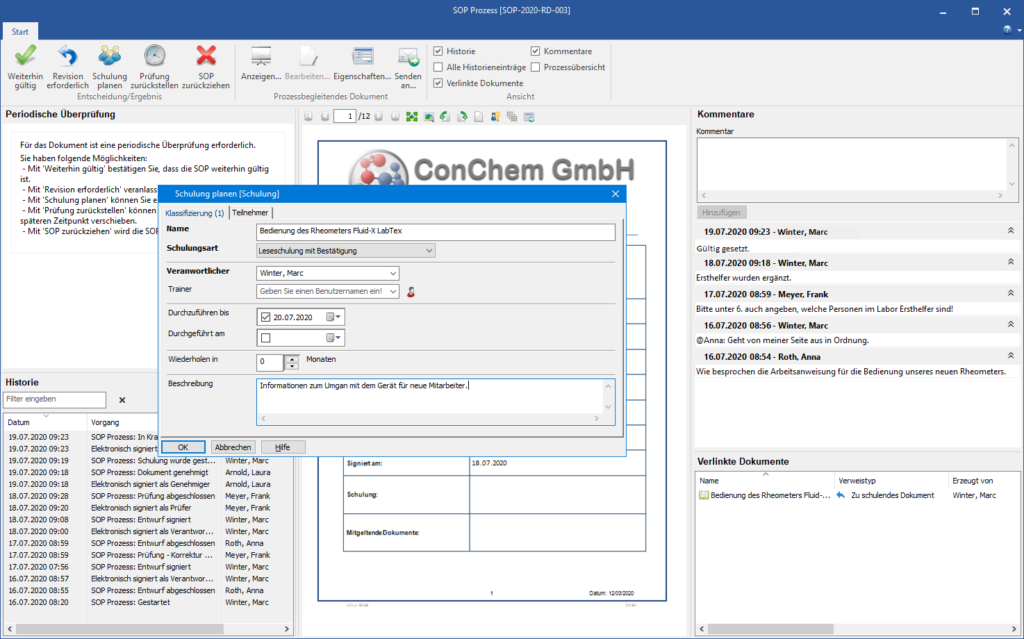
Schulung
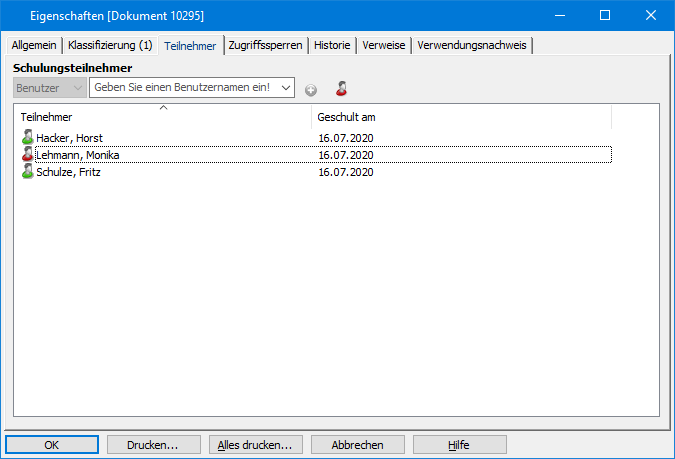
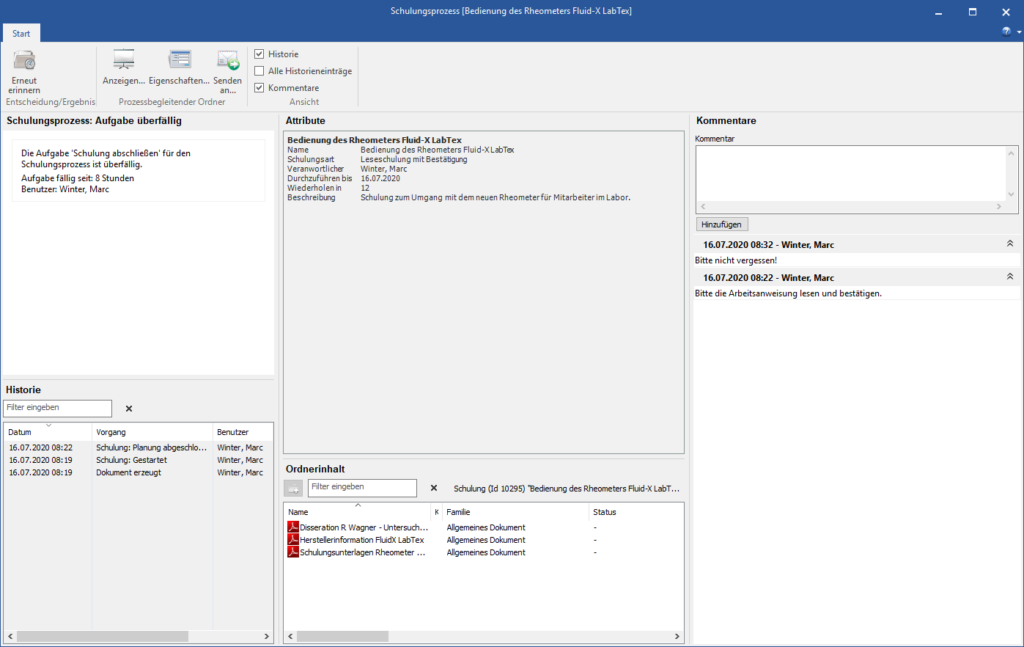
Das SOP-Management erfordert die lückenlose Dokumentation entsprechender Trainings bzw. Schulungen der Mitarbeiter. Diese wird innerhalb des Systems durch einen entsprechenden Workflow nachweisbar. Auch hier sorgt die elektronische Signatur des Schulungsteilnehmers als Beweis, dass die Schulung durchgeführt wurde für maximale Rechtssicherheit.
Inkrafttreten
Die SOP tritt mit Zeitstempel in Kraft. Der entsprechende Dokumenten Lifecycle bietet einen perfekten Audit Trail in regulierten Branchen.
Ersetzen
Neue Anforderungen oder geänderte Daten erfordern es eine SOP bzw. eine entsprechende Dokumentation wirksam zu ersetzen. Mit der COI-PharmaSuite ist diese Möglichkeit jederzeit gegeben – selbstverständlich dokumentiert der Audit Trail lückenlos alle Aktivitäten.
Zurückziehen
Auch das Zurückziehen einer SOP ist Teil des Lifecycles und mit der entsprechenden Berechtigung jederzeit möglich. Der Workflow unterstützt die notwendigen Maßnahmen.
Verteilung
Dank intelligenter Dokumentenmanagement Software ist die Verteilung und auch das Ersetzen der jeweils aktuellsten Version der SOPs ein einfacher und sicherer Prozess.
Periodische Prüfung und Review
Der vorgeschriebene, laufende Reviewprozess wird durch die automatisierte Erinnerungsfunktionen vereinfacht.
Abbildung SOP-Lifecycle
Über die Abbildung des SOP-Lifecycles hinaus unterstützt die COI-PharmaSuite folgende weitere Features
- Automatisiertes Erzeugen einer Coverpage inkl. Darstellung elektronischer Signaturen (Firma, Logo, Titel, Geltungsbereich, Verteiler)
- Automatisierte Generierung einer SOP-Nummer (Aufbau)
- Stempelung des Freigabestatus
- Elektronische Signaturen aller wichtigen Schritte
- Kontrollierte Kopien
- Schnittstelle zum Schulungsmanagement
Ihre Vorteile auf einen Blick
- Eine zentrale digitale Plattform für alle SOPs und mitgeltenden Unterlagen
- Jederzeitige Nachvollziehbarkeit des SOP-Lifecycles
- Elektronische Signaturen zur Authentifizierung aller wichtigen Prozessschritte ohne Medienbrüche
- Vollständige Audit-Trail-Protokollierung
- Volle Transparenz des Prozessfortschritts
- Erfüllung der regulatorischen Anforderungen und Guidelines (GxP)
- Rechtssichere Archivierung der Dokumente
Einblick in die Lösung:

Hinweis: Dies ist eine Playlist. Mit der Schaltfläche rechts oben im Video gelangen Sie zum nachfolgenden Clip.
Schulungsmanagement (Stand Alone oder im Rahmen der SOP möglich)
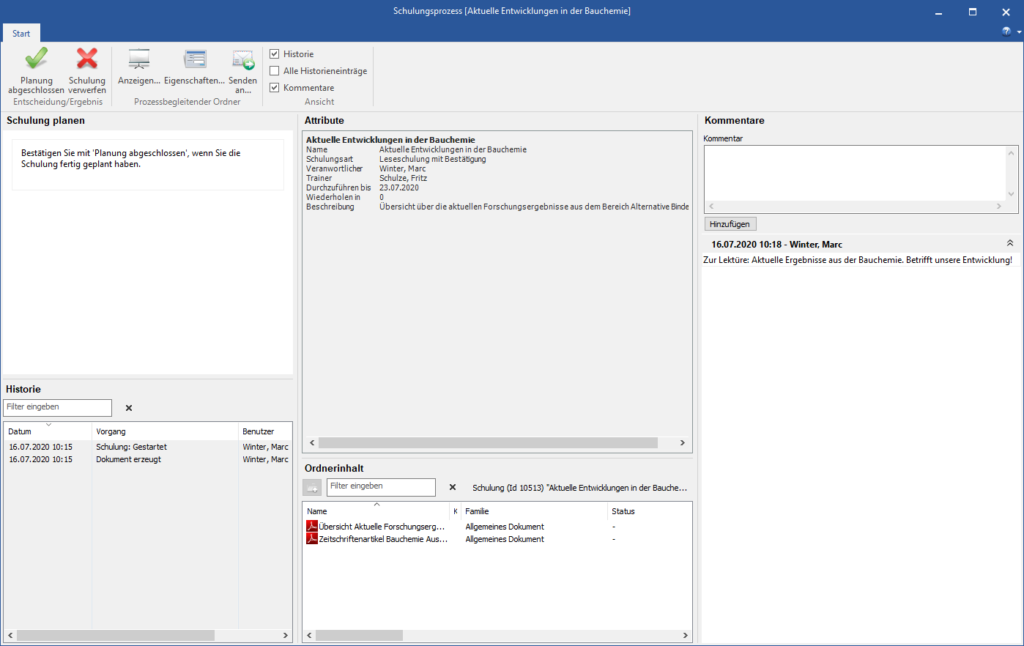
Kein SOP Management ohne Schulungsmanagement. Basis einer jeden Schulung ist ein zu schulendes Dokument – in stark regulierten Branchen oft eine SOP. Mit dem Modul Schulungsmanagement der COI-PharmaSuite können alle gesetzlichen Vorschriften hinsichtlich Transparenz und Dokumentation erfüllt werden.
Ihre Vorteile beim Schulungsmanagement mit der COI-PharmaSuite:
- kontrollierte Durchführung von Schulungen
- Verifikation der Schulungsdurchführung mit elektronischer Signatur und Zeitstempel
- Management von sich wiederholenden Schulungen (automatisierte Wiedervorlage)
- Dokumentations- und Nachweisbarkeit nach Richtlinien der European Medicines Agency (EMA) und der Food and Drug Administration (FDA)
- automatischer Schulungsworkflow bei Erneuerung/Änderung der SOPs
- Verknüpfung mit SOP Management (Inkrafttreten der SOP nach Schulungsdurchlauf)
Durch die Verknüpfung mit dem Dokumentenmanagement System (DMS) verfügen Sie im Vergleich zu anderen Schulungssystemen über eine vollständige Archivierung und die volle Auffindbarkeit aller jemals geschulten oder zu schulenden Dokumente.
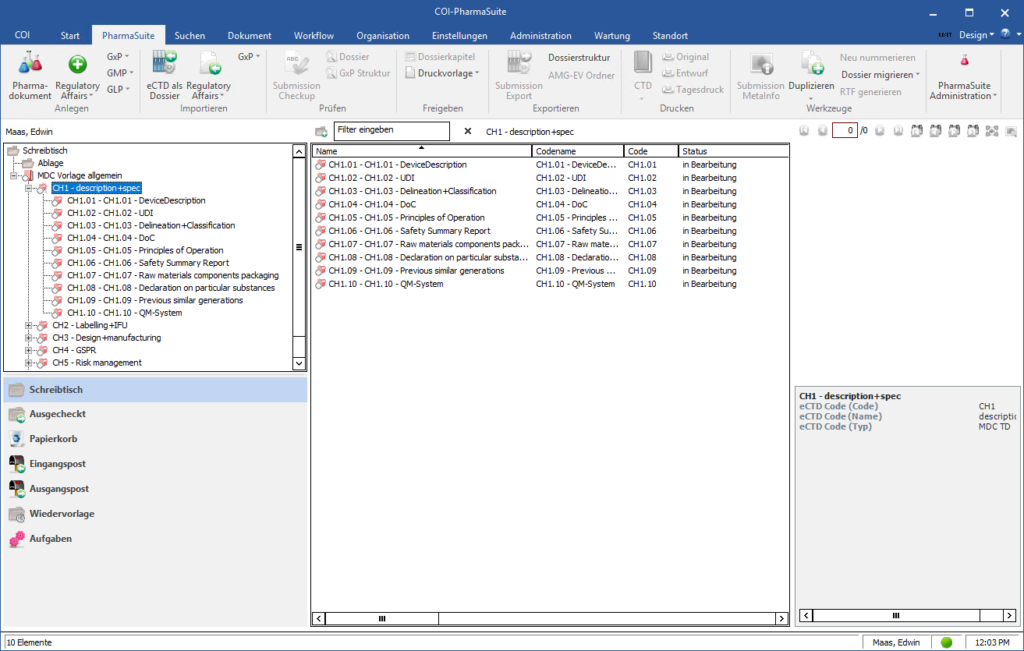
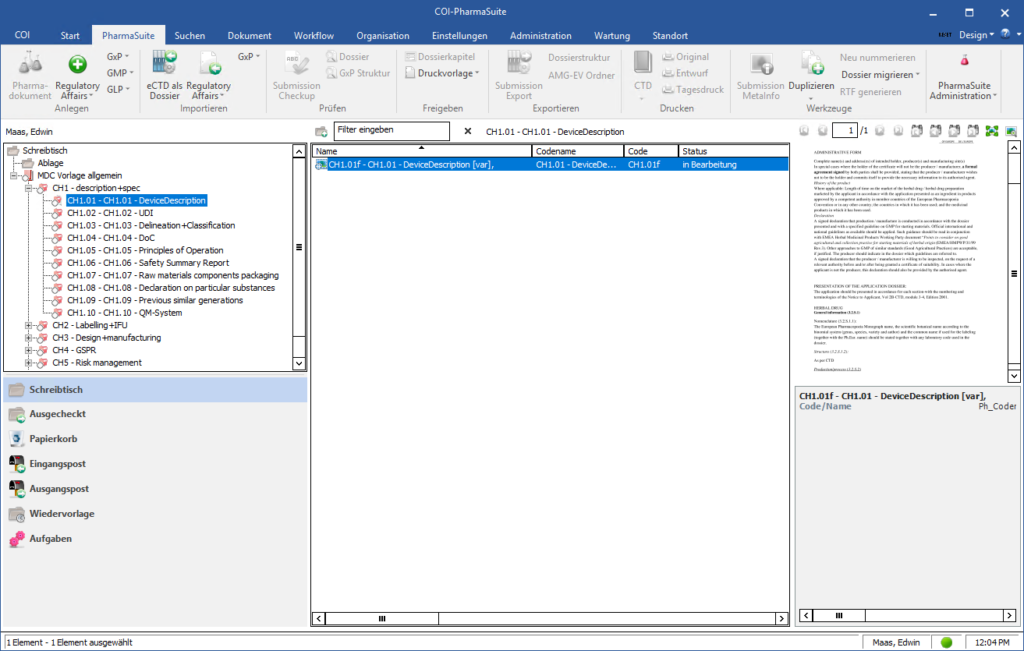
Technische Dokumentation von Medizinprodukten (STED)
Zur Erstellung und für das Management der Summary of Technical Documentation (STED) bei der Zulassung medizinischer Produkte findet sich innerhalb der COI-PharmaSuite ein eigens entwickeltes Modul.
Für die Produktgruppen In-vitro-Diagnostikum (IVD) und Non-In-vitro-Diagnostikum (Non-IVD) verfügt die Lösung über Strukturkataloge, die auf den aktuellen Vorgaben des IMDRF (International Medical Devices Regulators Forum) basieren. Selbstverständlich einschließlich der zugehörigen Metainformationen sowie der entsprechenden Nutzer-Rollen für die Erstellung, Änderung und Freigabe der Technischen Dokumentationen.
Ihre Vorteile auf einen Blick:
Eine Dokumentenmanagement Software – viele Schnittstellen
COI-BusinessFlow fügt sich nahtlos in Ihre bestehende Softwareumgebung ein – dank umfangreicher Schnittstellen.
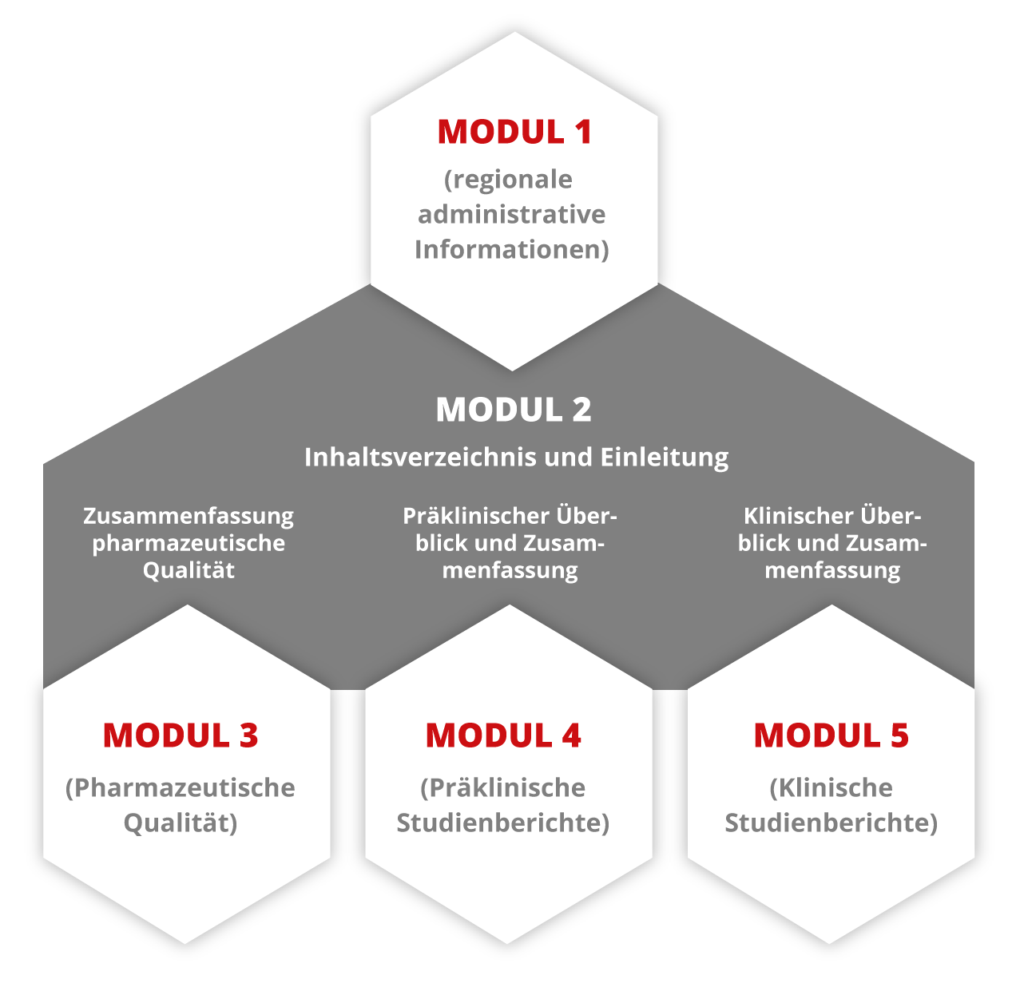
eCTD im Überblick
Mit der COI-PharmaSuite
den eCTD Standard erfolgreich umsetzen
- All in one Lösung für Dossier- und Dokumentenverwaltung
- eCTD Export (inkl. Validierung)
- eCTD Lifecycle
- eCTD Sequenz-Importer (optional)
- Sichere Dokumentenversionierung
- Präzise Dossiersequenzen
- Transparenter Audit Trail
Einfache Übernahme von extern erstellten eCTD-Sequenzen bzw. Abfolgen von eCTD-Sequenzen in die COI-PharmaSuite
- inklusive DMS Feature: komplette Übernahme der Dokumente inklusive aller bearbeitbaren Formate (Microsoft Word, Excel etc.)
eCTD steht für electronic Common Technical Document und ist eine Schnittstellenbeschreibung für den Standard-Einreichungsprozess bei der nationalen und internationalen Arzneimittelzulassung. Der eCTD-Export der COI-PharmaSuite bietet:
- ICH-konforme technische Transformation des Dossiers in einen validen eCTD Export (inkl. Backbone-Generierung, PDF-Konvertierung, Prüfsummen und Sequenzierung)
Die COI-PharmaSuite basiert auf dem performanten Dokumentenmanagement System COI-BusinessFlow.

Dokumente prozessoptimiert verwalten
COI – STARKE PARTNER
Durch die enge Kooperation mit unseren Partnern erweitern unsere Experten permanent ihr Know-how. Somit erkennen wir erfolgversprechende Trends frühzeitig und sichern Ihnen einen technologischen Vorsprung.

Sie haben spezielle Anforderungen? Wir beraten Sie gerne!
Weitere Module und Funktionen
Neben der Unterstützung der branchenspezifischen Prozesse wie Arzneimittelzulassung, Zulassung von medizinischen Produkten und spezifischem Qualitätsmanagement, bieten wir viele weitere Dokumentenmanagement Lösungen an. Klicken Sie auf die Kacheln für mehr Details.
News, Events & Webinare
Unsere Mission ist eine vollständige Digitalisierung von Unternehmensprozessen. Dazu gehört auch, sich auszutauschen und sich über aktuelle Trends und Themen zu informieren. Bleiben auch Sie up to date!